Anfang vom Ende der Pandemie?"Liebe Welt. Wir haben einen Impfstoff!"
 Von Kai Stoppel
Von Kai StoppelZum ersten Mal liefert ein nach westlichen Standards getesteter Corona-Impfstoff den Beleg: Es gibt einen Schutz vor einer Infektion. Die Fachwelt reagiert optimistisch: Von einem "Riesensprung" und einem "Silberstreifen am Horizont" ist die Rede. Allerdings äußern Experten auch Bedenken.
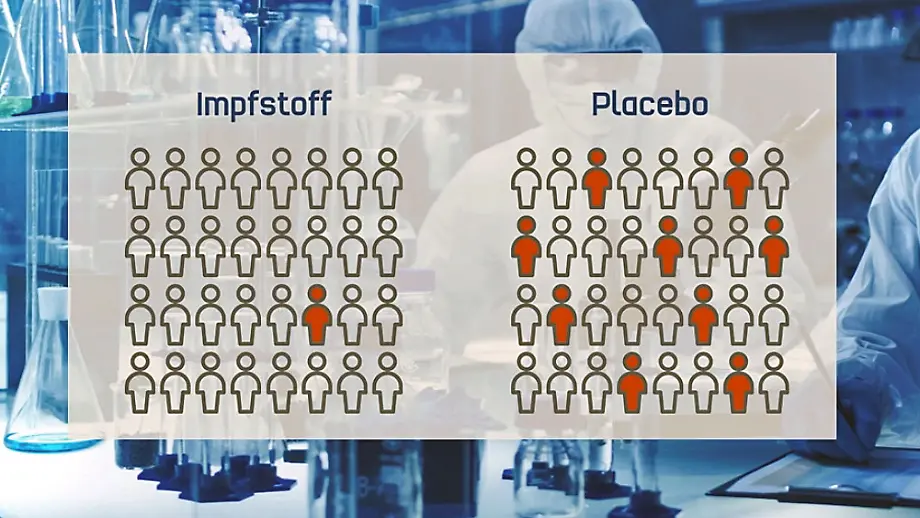
Es ist womöglich ein entscheidender Schritt im Kampf gegen die Coronavirus-Pandemie: Als erste westliche Hersteller haben das Mainzer Unternehmen Biontech und der Pharmakonzern Pfizer vielversprechende Ergebnisse einer für die Zulassung entscheidenden Studie veröffentlicht. Demnach bietet ihr Impfstoff einen mehr als 90-prozentigen Schutz vor der Krankheit Covid-19. Schwere Nebenwirkungen seien bislang nicht registriert worden, hieß es.
Die Reaktionen aus der Fachwelt sind entsprechend zuversichtlich: Der Virologe Florian Krammer von der Icahn School of Medicine in New York nannte die Bekanntgabe die "beste Nachricht" für ihn seit Beginn der Pandemie, schreibt er Twitter. Und er lässt sich sogar zu Einschätzung hinreißen: "Liebe Welt. Wir haben einen Impfstoff!"
Etwas zurückhaltender äußerte sich Clemens Wendtner von der München Klinik Schwabing, für den die vorgestellten Ergebnisse aber zumindest ein "Silberstreifen an dem sonst so düsteren Horizont" sind. Für den Fall der Zulassung macht Wendtner Hoffnung auf einen raschen Impfstart: "Wenn dieser Schritt erfolgen wird, könnte in der Tat bereits Ende 2020 eine Impfwelle anrollen."
Der Infektiologe Gerd Fätkenheuer von der Uniklinik Köln sprach von "großartigen und vielversprechenden Daten". "Ich denke, das wird unseren Umgang mit der Pandemie entscheidend beeinflussen, und ich hoffe, dass rasch große Mengen des Impfstoffes zur Verfügung stehen werden." Allerdings gaben Experten auch zu bedenken, dass die Daten zunächst nur aus einer Pressemitteilung stammen und nicht aus einer wissenschaftlichen Publikation. So fehlten etwa Informationen zum Schutzeffekt in bestimmten Altersgruppen und dazu, wie lange ein Impfschutz anhält.
Weltärztepräsident Frank Ulrich Montgomery sprach von einem "Riesensprung nach vorne", warnte aber ebenfalls, es sei noch kein "Durchbruch". Es fehlten noch wissenschaftliche Arbeiten, sagte Montgomery dem Redaktionsnetzwerk Deutschland. Er verwies auch darauf, dass "große Erfahrungen mit RNA-Impfstoffen", deren Wirkmechanismus auf Ribonukleinsäure beruhen, "bisher nicht vorhanden" seien.
Lauterbach: ein "Durchbruch"
Der SPD-Gesundheits-Experte Karl Lauterbach bewertete den Impfstoff ein "Durchbruch". "Es sind Zwischenergebnisse, aber diese Zwischenergebnisse fallen deutlicher aus, als es in Fachkreisen erwartet worden war", sagte Lauterbach. "Das ist großartig." Es sei zudem ein Impfstoff, der wahrscheinlich nur wenige Nebenwirkungen habe. "Ich war immer fest davon überzeugt, dass uns der Impfstoff gelingt", sagte Lauterbach. Er könne sich vorstellen, dass der Impfstoff im Januar erstmals zum Einsatz kommen könnte.
Biontech hatte den Impfstoff BNT162b2 im Projekt "Lightspeed" (Lichtgeschwindigkeit) seit Mitte Januar entwickelt. Die für eine Zulassung entscheidende Phase-3-Studie begann ab Ende Juli in verschiedenen Ländern. Bis Montag haben mehr als 43.500 Menschen mindestens eine der beiden Impfungen bekommen, die im Abstand von drei Wochen verabreicht werden. Ein Impfschutz wird nach Angaben der Hersteller eine Woche nach der zweiten Injektion erreicht.
In der Studie wurden demnach bis Sonntag insgesamt 94 Covid-19-Fälle bestätigt - bei der Studie erhält die Hälfte der Teilnehmer eine Impfung, die andere Hälfte nur ein Placebo. Doch weder die Teilnehmer, noch das Unternehmen oder die teilnehmenden Ärzte wissen, wer was bekommen hat. Erst nachdem eine gewisse Anzahl an Teilnehmern erkrankt, wird überprüft, wie viele davon den Impfstoff bekommen haben und wie viele das Placebo.
Nun wurde bei 94 Erkrankten ein Zwischenergebnis gezogen. Abschließend werden die Ergebnisse nach Angaben von Biontech und Pfizer aber erst dann ausgewertet, wenn insgesamt 164 Teilnehmer erkrankt sind. Dabei werde auch geprüft, in welchem Maß die Impfung nicht nur vor Covid-19 schützt, sondern auch vor schweren Verläufen der Krankheit. Insgesamt sollen sowohl die Schutzwirkung als auch etwaige Nebenwirkungen über einen Zeitraum von zwei Jahren beobachtet werden.
Das Biontech-Präparat ist ein sogenannter RNA-Impfstoff, der auf einem bislang völlig neuen Mechanismus basiert. Er enthält genetische Informationen des Erregers, aus denen der Körper ein Viruseiweiß herstellt - in diesem Fall das Oberflächenprotein, mit dessen Hilfe das Virus in Zellen eindringt. Ziel der Impfung ist es, den Körper zur Bildung von Antikörpern gegen dieses Protein anzuregen, um die Viren abzufangen, bevor sie in die Zellen eindringen und sich vermehren. Ein Vorteil von RNA-Impfstoffen ist, dass sie wesentlich schneller als konventionelle Impfstoffe produziert werden können. Biontech und Pfizer rechnen damit, noch in diesem Jahr weltweit bis zu 50 Millionen Impfstoff-Dosen bereitzustellen, im kommenden Jahr kalkulieren sie mit bis zu 1,3 Milliarden Dosen.
Bis zu 300 Millionen Biontech-Impfdosen für EU
Die EU-Kommission verhandelt bereits seit einiger Zeit mit Biontech/Pfizer über einen Rahmenvertrag zur Lieferung des Impfstoffs an alle EU-Staaten. Dazu gebe es aber nichts Neues, sagte ein Kommissionssprecher am Montagmittag. Bereits im September hatte die Kommission erklärt, sie wolle bis zu 300 Millionen Impfdosen von Biontech bestellen. Unterzeichnet hat sie Rahmenverträge bisher mit den Pharmafirmen Johnson&Johnson, Astrazeneca und Sanofi-GSK.
Für Corona-Impfstoffe gilt wegen der besonderen Dringlichkeit ein beschleunigter Zulassungsprozess. Bei der Europäischen Arzneimittel-Agentur können Hersteller schon vor dem kompletten Zulassungsantrag einzelne Teile zu Qualität, Unbedenklichkeit und Wirksamkeit eines Präparats einreichen. Ein solches Rolling-Review-Verfahren hat neben Biontech auch das britisch-schwedische Unternehmen Astrazeneca für seinen Impfstoff-Kandidaten gestartet.
Astrazeneca hat bisher keine Phase-3-Daten veröffentlicht. Zum Zeitplan dafür lasse sich noch nichts sagen, teilte eine Sprecherin mit. Zwar haben schon Länder wie Russland, China und kürzlich erst Bahrain Impfstoffe mit Einschränkungen freigegeben und impfen damit bereits Teile der Bevölkerung. Aber wie gut diese Impfungen tatsächlich schützen und welche Nebenwirkungen sie haben können, ist derzeit weitgehend offen.
Die Weltgesundheitsorganisation äußert sich angesichts der Fortschritte bei der Entwicklung eines Impfstoffs gegen das Coronavirus optimistisch. Bei einer Auslieferung bis März kommenden Jahres an jene, die für das Virus am meisten anfällig seien, könnte der Verlauf der Pandemie ein fundamental andere Richtung einschlagen, sagte der WHO-Spitzenvertreter Bruce Aylward. Die Mitteilung der Pharmafirmen BionTech und Pfizer, wonach deren Impfstoffkandidat eine hohe Wirksamkeit zeigt und sie noch im November in den USA einen Zulassungsantrag einreichen wollen, nannte Aylward "sehr positiv".