"Macht die Raupen schlaff"Bakterium tötet Larven mit Gift in Seepferdchen-Form
Ein Bakterium tötet Insekten mit einem Gift, das übersetzt "Macht Raupen schlaff 1" heißt. Forschende des Dortmunder Max-Planck-Instituts finden heraus, wie das Toxin wirkt, was wichtig für die Entwicklung von Bio-Pestiziden ist, aber auch Menschen direkt helfen kann.
Das Bakterium Photorhabdus luminescens tötet Insektenlarven, indem es sie mit dem Toxin Mcf1 vollpumpt. Das Kürzel steht für "Makes caterpillars floppy 1" ("Macht Raupen schlaff 1"), was wörtlich zu nehmen ist. Denn bevor die Larven sterben, erschlaffen sie durch das Gift. Forschende des Max-Planck-Instituts für molekulare Physiologie haben jetzt die Struktur von Mcf1 entschlüsselt und können damit erklären, wie das Toxin seine verheerende Wirkung entfaltet. Diese Erkenntnisse sollen dabei helfen, neuartige Bio-Pestizide zu entwickeln.
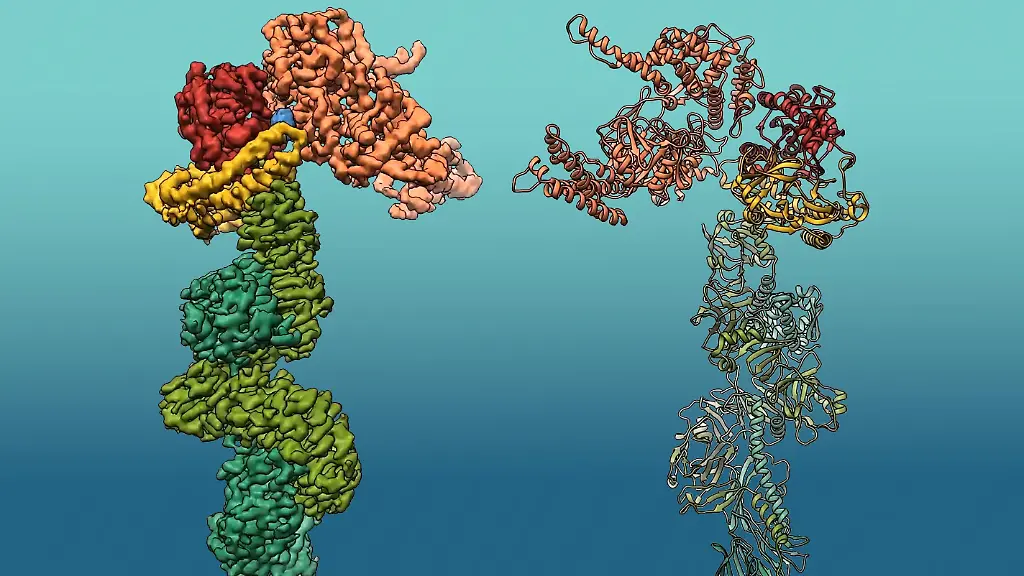
Größe und Aufbau des Proteins, bestehend aus mehreren Modulen mit unterschiedlichen Funktionen, hätten die Forschenden lange Zeit vor eine schier unlösbare Herausforderung gestellt, heißt es in der Pressemitteilung des Max-Planck-Instituts. "Unsere Arbeit stellt die allererste Strukturstudie über dieses Toxin dar", sagt Erstautor Alexander Belyy. Entscheidend für die Auflösung dieser Struktur sei der Einsatz hochmoderner Kryo-Elektronenmikroskopie und leistungsfähiger Rechner gewesen, erklärt Stefan Raunser, Direktor am Max-Planck-Institut für molekulare Physiologie.
Seepferdchen-Struktur zeigt sich unter Elektronenmikroskop
Die Technik erlaubte es den Forschenden, 3D-Bilder des Proteins mit nahezu atomarer Auflösung zu erzeugen. Details, 200.000 Mal kleiner als die Breite eines menschlichen Haares, können auf diese Weise beobachtet werden. So zeigte sich, dass die Struktur von Mcf1 der Form eines Seepferdchens ähnelt.
Nachdem die Bakterien das Toxin im Wirtsinsekt über den "Kopf" freigesetzt haben, identifizieren drei Domänen im "Schwanz" die Membran der Zielzelle und binden daran. Eine andere Domäne schleust dann den "Kopf" des Toxins durch die Membran in das Zytoplasma der Zelle ein. Dort interagiert er mit lokalen Wirtsproteinen, um die Freisetzung von zwei Giftstoffen zu stimulieren. Diese stören die Aktivität lebenswichtiger Proteine, was den Wirt innerhalb von 24 Stunden tötet.
Ein Detail fehlt noch
In Zukunft möchten die Forschenden noch im molekularen Detail aufklären, wie die Giftstoffe von Mcf1 zum Zelltod führen. Damit sei es dann möglich, hochspezifische insektizide Toxine für die ökologische Schädlingsbekämpfung zu entwickeln, sagt Stefan Raunser.
Die Forschung hat aber möglicherweise auch Auswirkungen auf das Verständnis menschlicher Krankheiten. Denn die Forschenden fanden ebenfalls heraus, dass der modulare Aufbau des Schwanzes und die ersten Schritte der Mcf1-Vergiftung den Toxinen von Clostridioides difficile stark ähneln. Dieser menschliche Krankheitserreger ist verantwortlich für jährlich mehr als 120.000 Krankenhausaufenthalte in Europa.