Für ungeimpfte RisikopatientenEMA empfiehlt Astrazeneca-Medikament
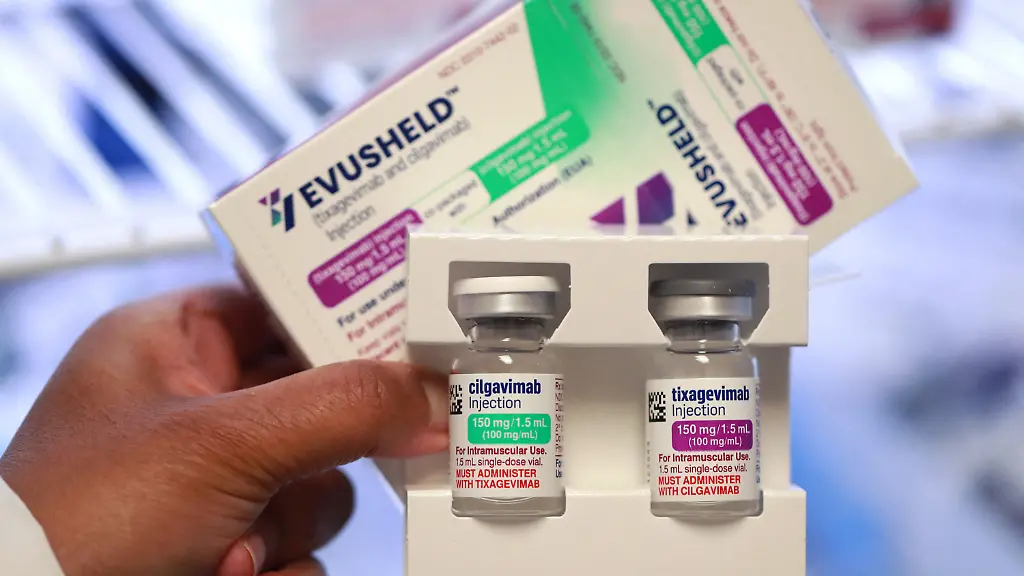
Evusheld soll Abhilfe für Menschen schaffen, die zur Risikogruppe gehören, sich aber nicht impfen lassen können. Die EMA hat das Mittel von Astrazeneca nun zur Zulassung empfohlen, nachdem eine Studie mit 5000 Erwachsenen erfolgversprechende Ergebnisse erzielt hatte.
Die Europäische Arzneimittelbehörde EMA hat die Zulassung eines Corona-Medikaments von Astrazeneca empfohlen, das Risikopatienten, die nicht geimpft werden können, vor einer Infektion schützen soll. Das Komitee für Humanmedizin empfehle die Marktzulassung für Evusheld "zur Vorbeugung von Covid-19 bei Erwachsenen und Jugendlichen ab 12 Jahren und einem Gewicht ab 40 Kilogramm", erklärte nun die in Amsterdam ansässige Behörde.
Evusheld kombiniert zwei Arten von synthetischen Antikörpern, die in Form von zwei Spritzen direkt nacheinander verabreicht werden. Diese Antikörper helfen dem Immunsystem, das Virus zu bekämpfen, indem sie auf das Spike-Protein anspringen, das es dem Virus ermöglicht, in die Körperzellen einzudringen.
Die EMA verwies bei ihrer Entscheidung auf eine Studie mit 5000 Erwachsenen, bei denen das Risiko einer Ansteckung nach dem Erhalt der zwei Spritzen um 77 Prozent gesenkt werden konnte. Der Schutz vor einer Corona-Infektion hielt laut EMA mindestens sechs Monate an, die Nebenwirkungen waren "im Allgemeinen gering". Zu den Nebenwirkungen können etwa eine allergische Reaktion, Blutungen an der Injektionsstelle, Kopfschmerzen und Müdigkeit gehören. Allerdings stammte die Studie noch aus der Zeit vor dem Aufkommen der Omikron-Variante.
Laut der Europäischen Arzneimittelbehörde weisen Laborstudien darauf hin, dass die Omikron-Subvariante BA.1 "weniger empfindlich" auf das Medikament reagiert als die Untervariante BA.2. Die Empfehlung der EMA wird nun zur endgültigen Genehmigung an die Europäische Kommission weitergeleitet. Bereits im Dezember hatte Evusheld die Notfallzulassung der US-Arzneimittelbehörde FDA erhalten. Der FDA zufolge darf es nicht an Menschen verabreicht werden, die bereits infiziert sind - Astrazeneca erforscht jedoch eine entsprechende Anwendung.